

Funktion der PEMFC
Bei einer PEM-Brennstoffzelle wird ein edelmetallhaltiger Katalysator eingesetzt, meistens handelt es sich hierbei um Platin. Ohne das Platin würden Wasserstoff und Sauerstoff nicht miteinander reagieren. Erst die Zufuhr der Aktivierungsenergie, z.B. durch einen Funken, würde die Reaktion explosionsartig ablaufen lassen. Das Elektrolyt ist eine Polymermembran, die nur Protonen durchlässt.
Die Protonen und Elektronen entstehen an der Anode durch Oxidation von Wasserstoff. Hierbei entsteht an der Anode ein Gleichgewicht zwischen adsorbierten Wasserstoff-Molekülen und hydratisierten Wasserstoff-Ionen. Die Protonen, also die H+-Ionen, wandern durch die Membran zur Kathode, an der die Reduktion von Sauerstoff zu Wasser stattfindet.
Die für die Reduktion nötigen Elektronen fließen durch einen äußeren Stromkreis zur Kathode. Die hierbei stattfindende Aufladung der Elektroden bezeichnet man als Elektrodenpotential. Die bei der Reaktion zwischen den beiden Elektroden erzeugte Potentialdifferenz ist die treibende Kraft der Brennstoffzellenreaktion und lässt sich im äußeren Stromkreis in elektrische Arbeit umwandeln.
Anode: | 2H2(g) => 4H+ + 4e- | Kathode: | O2(g) + 4e- => 2 O2- |
Gesamtreaktion: | 2H2(g) + O2(g) => 2H2O(g) |
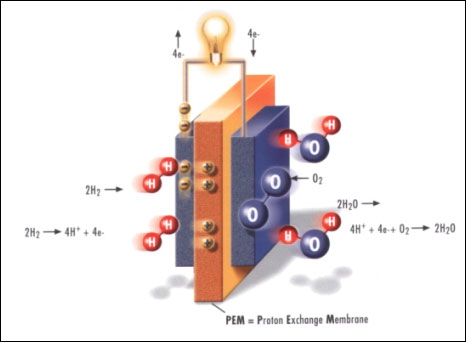
Funktionsskizze der PEMFC (Bild: H-TEC)
Theoretisch lässt sich an einer PEM-Brennstoffzelle eine Ruhespannung von 1,23V messen. Diese ergibt sich aus den Standard-Elektrodenpotentialen.
Allgemein gilt: U = UH0(Kathode) - UH0(Anode).
Daraus folgt für die PEM-Brennstoffzelle, die mit Sauerstoff und Wasserstoff betrieben wird:
U = UH0(Sauerstoff) - UH0(Wasserstoff) = 1,23V - 0V = 1,23V.
Das Elektrodenpotential der Wasserstoffhalbzelle ist definitionsgemäß 0V. Daraus ergibt sich dann die theoretisch mögliche Spannung von 1,23V. In der Praxis wird diese Spannung aber nicht erreicht; man erreicht nur Spannungen zwischen 0,6 bis 0,9V. Dies ist auf Spannungsverluste, die z.B. durch Reaktionshemmungen oder ungenügende Gasdiffusion auftreten können.
Diese theoretisch frei werdende Spannung entspricht der Spannung, die man theoretisch mindestens bei der Elektrolyse von Wasser aufbringen muss. Aber auch bei einer Elektrolyse ist diese theoretische Spannung nicht ausreichend, da auch hier u.a. der ohmsche Widerstand des Elektrolyten zu überwinden ist und somit die Spannung höher sein muss.
Die Brennstoffzelle kann je nach Typ und Brennstoff einen theoretischen Wirkungsgrad von 70% bis annähernd 100% erreichen. Da, wie eben schon erklärt, in der Praxis nicht die volle theoretische Spannung erreicht wird, liegt auch der tatsächliche Wirkungsgrad niedriger, zwischen 40% und 70%. Er entspricht dem Quotienten aus erreichter Spannung und theoretischer Spannung. Am Wirkungsgrad kann man das Verhältnis zwischen gewonnener und aufgewandter Energie ablesen.
2000-2026 © dieBrennstoffzelle.de